Laser |
La première application médicale du laser a eu lieu en 1961 ! il s’agissait d’un traitement d’une tumeur de la rétine. Aujourd’hui, le laser est à l’origine de près de 200 000 interventions par an en France et ses applications sont de plus en plus nombreuses.
Définition
Acronyme anglais de Light Amplification by Stimulated Emission of Radiation, le laser se traduit en français par « amplification de la lumière par émission stimulée de radiations ».
Concrètement, il s’agit d’une source de lumière intense émise en règle générale sur une seule longueur d’onde (donc dans une seule couleur) et dans une seule direction, dégageant ainsi localement une très grande densité énergétique.
L’utilisation des rayons laser est très variée en médecine.
Le bistouri du XXIe siècle
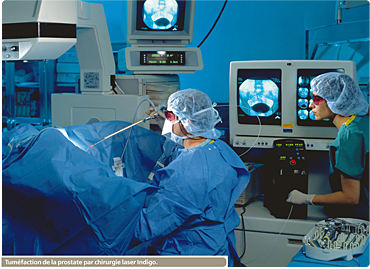
 Les lasers sont devenus des outils privilégiés pour les chirurgiens : en concentrant le faisceau de lumière sur des zones très précises des tissus du corps humain, il est en effet possible de sectionner ou de réparer des tissus, de coaguler des vaisseaux sanguins ou encore de détruire des lésions sans abîmer les zones voisines. Ils s’avèrent beaucoup moins agressifs que les techniques chirurgicales classiques. Non seulement les traitements sont plus rapides, mais ils sont aussi moins traumatiques (geste chirurgical plus précis, incisions plus fines, etc.) et évitent souvent l’hospitalisation. Les lasers ne sont toutefois pas des remèdes miracles car ils comportent des risques comme la brûlure et le vieillissement cellulaire.
Les lasers sont devenus des outils privilégiés pour les chirurgiens : en concentrant le faisceau de lumière sur des zones très précises des tissus du corps humain, il est en effet possible de sectionner ou de réparer des tissus, de coaguler des vaisseaux sanguins ou encore de détruire des lésions sans abîmer les zones voisines. Ils s’avèrent beaucoup moins agressifs que les techniques chirurgicales classiques. Non seulement les traitements sont plus rapides, mais ils sont aussi moins traumatiques (geste chirurgical plus précis, incisions plus fines, etc.) et évitent souvent l’hospitalisation. Les lasers ne sont toutefois pas des remèdes miracles car ils comportent des risques comme la brûlure et le vieillissement cellulaire.
Différents types
Plusieurs types de laser sont utilisés en médecine. Parmi les plus courants, on trouve :
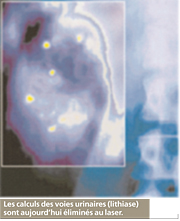
Le laser à gaz carbonique (ou laser CO2)
Selon la puissance et la forme du faisceau, il peut vaporiser une lésion par la chaleur qu’il dégage ou la découper très précisément, comme un bistouri à lame, tout en coagulant. Son avantage est la rapidité d’action et l’absence de saignements. Le chirurgien peut, ensuite, laisser cicatriser ou suturer la plaie opératoire.
Le laser argon
Il agit par photocoagulation en provoquant de petites brûlures très localisées grâce à l’émission d’une lumière rouge qui va être absorbée par les vaisseaux de la peau. Peu puissant, il ne traite que les lésions superficielles et s’avère surtout intéressant en dermatologie pour le traitement des angiomes plans ou stellaires, de la couperose ou des télangiectasies, ainsi qu’en ophtalmologie pour la prévention du décollement de la rétine, de la dégénérescence maculaire et du glaucome.
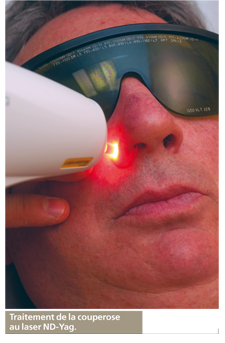
Le laser Yag
 Il agit en sectionnant grâce à l’émission d’impulsions très brèves (en dessous du milliardième de seconde) qui produisent peu de chaleur, mais ont une action mécanique semblable à celle d’un bistouri à lame. Son emploi est très large puisqu’il va de la chirurgie très fine de l’œil à certains cancers pulmonaires ou digestifs. Ce laser a en effet l’avantage de pouvoir être introduit à l’intérieur d’une fibre optique, permettant ainsi d’intervenir à l’intérieur du corps.
Il agit en sectionnant grâce à l’émission d’impulsions très brèves (en dessous du milliardième de seconde) qui produisent peu de chaleur, mais ont une action mécanique semblable à celle d’un bistouri à lame. Son emploi est très large puisqu’il va de la chirurgie très fine de l’œil à certains cancers pulmonaires ou digestifs. Ce laser a en effet l’avantage de pouvoir être introduit à l’intérieur d’une fibre optique, permettant ainsi d’intervenir à l’intérieur du corps.
Le laser Excimer
Il agit par photoablation. L’émission d’une lumière dans l’ultraviolet provoque de petites pertes de substance. Son domaine privilégié est l’ophtalmologie, et plus particulièrement celui du traitement de la myopie ou de certaines opacités superficielles de la cornée.
La thérapie génique |
Réparer, ou remplacer, un gène défectueux pour corriger les erreurs de la Nature, c’est la promesse de la thérapie génique. Génératrice d’espoirs les plus fous, cette nouvelle approche médicale, jugée aussi révolutionnaire que la vaccination ou la découverte des antibiotiques en leur temps, se heurte toutefois à des problèmes techniques, mais aussi éthiques.
Principe
Depuis l’établissement, en 1993, de la cartographie du génome humain et son décryptage en 2003, on connaît de mieux en mieux le fonctionnement des gènes et notamment, quel gène-code s’associe à quelle protéine et à quelle fonction du corps il se rapporte.
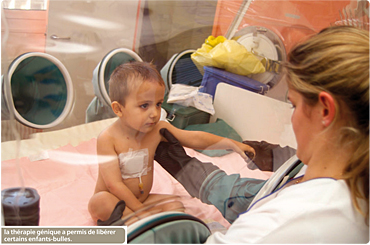
Une première française
Mais c’est en 1999 que le professeur Alain Fischer, chercheur à l’Inserm (Institut national scientifique d’études et de recherches médicales) a démontré la puissance de cette technique, et le formidable espoir qu’elle pouvait engendrer, en réalisant – à l’hôpital Necker (Paris) – le premier essai de thérapie génique, couronné de succès, sur l’être humain. Il a travaillé avec un groupe d’enfants atteints d’une maladie génétique qui rendait leur système immunitaire déficient (déficit immunitaire combiné sévère lié au chromosome x ou dics-x). Ces enfants étaient contraints de vivre sous bulle, dans une atmosphère totalement stérile. L’équipe du professeur Fischer a isolé le gène en cause avant de prélever, sur les patients, des cellules souches (cellules capables de se transformer en plusieurs types de cellules). Puis, en laboratoire, un gène sain a été introduit dans ces cellules avant de les réinjecter dans les organismes des enfants : les dix jeunes patients traités ont pu sortir de leur bulle. Toutefois, deux d’entre eux ont développé une leucémie et un seul a pu être sauvé. Cette tragédie a entraîné une suspension des essais sur l’homme entre 2002 et 2004 mais, devant un tel taux de réussite, 98 %, ils ont repris très vite. Les chercheurs ont ainsi pu identifier les raisons pour lesquelles ces deux enfants – et pas les autres – avaient déclenché des cancers : dans leur organisme, le gène-médicament s’est implanté à proximité de celui qui gère la production des globules rouges et des lymphocytes. Un « accident » qui peut être prévenu par les praticiens.
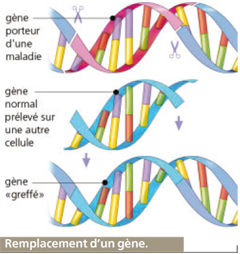 Concept
Concept
Dès lors, on peut imaginer soigner en utilisant les gènes de deux façons distinctes :
Le remplacement
Même si le concept est séduisant, remplacer un gène déficient par un gène sain reste aujourd’hui le projet thérapeutique le plus difficile, d’un point de vue technique, à mettre en place.
L’apport thérapeutique
Il s’agit ici d’utiliser le gène comme un médicament capable de coder une protéine pour amener celle-ci à déclencher des effets contrebalançant ceux, néfastes, du gène malade.
Fonctionnement
Identification du gène déficient
C’est évidemment la première étape. Devant une affection donnée, congénitale ou acquise, il faut déterminer quels sont les gènes impliqués. Une fois cette identification effectuée, les chercheurs isolent un gène-médicament et le clonent en laboratoire.
Implatation du gène-remède
Pour introduire le gène-médicament dans la cellule infectée, les scientifiques utilisent un vecteur. Le plus souvent, il s’agit d’un rétrovirus car celui-ci a la faculté de migrer et de transverser la membrane cytoplasmique pour atteindre le noyau des cellules de certains organes. Il y a alors réplication de son ADN, ou son de ARN, à l’intérieur de la cellule et, lorsque celle-ci se reproduit, elle le fait avec les propriétés du virus. C’est le mécanisme de l’infection.
Dans le cadre de la thérapie génique, on manipule le virus de manière à le rendre inoffensif puis on remplace son ADN (ou ARN) par celui d’un gène-médicament qui contrôle la production d’une protéine spécifique afin d’induire un effet thérapeutique.
Une infection soignante
Ensuite, le virus va pénétrer la cellule-cible et utilisera le pouvoir de réplication de celle-ci de manière à « infecter » d’autres cellules et leur conférer ainsi les propriétes thérapeutiques du gène-médicament.
Atteinte de la cellule-cible
Les généticiens disposent de trois techniques pour s’assurer que le virus atteigne la bonne cellule-cible et éviter les conséquences désastreuses des premiers essais :
• In vivo. Le virus est introduit dans la circulation sanguine par une banale piqûre avant d’être transporté, par le sang, jusqu’aux cellules-cibles.
• In situ. Dans ce cas, on introduit directement le vecteur modifié dans l’organe concerné.
• In vitro. On prélève, sur un malade, les cellules à modifier et on y introduit , en laboratoire, le virus porteur du gène-médicament. Les cellules transformées sont ensuite réinjectées dans les tissus du patient.
La greffe d'organe |
 La greffe est le remplacement d’un organe défaillant par un organe sain appelé « greffon ». La transplantation est devenue possible grâce aux progrès de l’im-munologie, et son succès dépend essentiellement de la compatibilité entre donneur et receveur. Le point sensible reste le délai d’attente, variable selon les organes, qui peut atteindre plusieurs années.
La greffe est le remplacement d’un organe défaillant par un organe sain appelé « greffon ». La transplantation est devenue possible grâce aux progrès de l’im-munologie, et son succès dépend essentiellement de la compatibilité entre donneur et receveur. Le point sensible reste le délai d’attente, variable selon les organes, qui peut atteindre plusieurs années.
Être donneur
Le don d’organes repose sur le consentement présumé. Tout citoyen est donneur potentiel d’organes (loi du 6 août 2004) à moins de s’y être opposé de son vivant (inscription sur le Registre national des refus). Sans indication spécifique de la volonté du défunt, l’équipe médicale peut s’informer auprès des proches de celui-ci, qui peuvent, ou non, s’y refuser. D’où l’importance de faire les démarches nécessaires avant sa mort si l’on désire faire don de ses organes.
On peut prélever les organes sur :
Une personne décédée cliniquement (victimes d’accidents vasculaires cérébraux et de traumatismes).
Seules les personnes déclarées en état Moneygram point de mort encéphalique dans un service de réanimation peuvent être prélevées. La constatation de cet état est signée par deux médecins .
Un donneur vivant
Il doit être majeur et proche du receveur (conjoint, parents, enfants, frères, sœurs, grands-parents, conjoint de la mère ou du père ou toute personne apportant la preuve d’une vie commune d’au moins deux ans avec le receveur, …). La transplantation ne concerne généralement que les reins, mais le don d’un poumon ou d’un lobe du foie est possible.
Prélèvement
Il se fait en plusieurs temps :
La recherche de contre-indications au prélèvement (maladies transmissibles, virales) est réalisée pour éviter les risques pour le receveur.
Le prélèvement est réalisé par des équipes habilitées, en bloc opératoire.
Chaque organe est isolé et conditionné spécifiquement pour préserver sa conservation. Le corps du défunt est traité avec respect et attention avant d’être restitué à la famille.
 Les organes sont acheminés vers les centres de transplantation des receveurs. Le moyen de transport – routier ou aérien – est défini en fonction de leur temps de conservation (4 heures pour le cœur ; 10 heures pour le foie et les poumons ; 36 heures pour le rein), et de leur destination.
Les organes sont acheminés vers les centres de transplantation des receveurs. Le moyen de transport – routier ou aérien – est défini en fonction de leur temps de conservation (4 heures pour le cœur ; 10 heures pour le foie et les poumons ; 36 heures pour le rein), et de leur destination.
Le receveur est prévenu de la disponibilité d’un greffon par l’équipe médicale qui le suit. Il est pris en charge, en urgence, dans le centre de greffe. Après vérification de l’absence de contre-indications de dernière minute, il est préparé à recevoir le greffon.
L’équipe de coordination hospitalière représente un maillon essentiel dans ce circuit « donneur/receveur », car elle assure le lien entre les différentes équipes qui sont amenées à intervenir.
Mort encéphalique
C’est la destruction totale et irréversible de l’ensemble des structures du cerveau constatée par trois critères cliniques :
-l’absence totale de conscience et d’activité motrice spontanée,
-l’abolition de tous les réflexes du tronc cérébral,
-l’absence totale de ventilation spontanée.
Le caractère irréversible est confirmé par deux électroencéphalogrammes non réactifs, effectués à 4 h d’intervalle, ou par une angiographie cérébrale montrant l’arrêt de l’irrigation du cerveau. La respiration et les battements du cœur peuvent être maintenus quelques heures supplémentaires par des techniques de réanimation.
Attribution d’un organe
Les règles de répartition et d’attribution des greffons prélevés sur le corps de personnes décédées sont définies par l’Agence de la biomédecine. Les bénéficiaires prioritaires sont :
 Les personnes en sursis ayant une défaillance aiguë pouvant conduire à une mort à court terme (cœur, foie, rein) .
Les personnes en sursis ayant une défaillance aiguë pouvant conduire à une mort à court terme (cœur, foie, rein) .
Les malades à faible potentiel, c’est-à-dire à faible probabilité d’obtenir un greffon.
Les enfants
En dehors de ces priorités, il faut tenir compte de la compatibilité entre donneur et receveur, de la place sur la liste d’attente, de la proximité entre le centre de transplantation et le lieu de prélèvement.
Rejet de la greffe
C’est une réaction de défense développée par l’organisme du receveur. Le greffon, qui porte les antigènes propres au donneur, ne va pas être reconnu, et l’organisme du receveur va mobiliser les cellules de son système immunitaire (les lymphocytes T) pour l’éliminer. Afin de lutter contre ce phénomène naturel, les transplantés prennent toute leur vie des traitements appelés immunosuppresseurs.
Diversité des greffes
Moins connue, mais plus fréquemment pratiquée car les greffons sont plus facilement obtenus, la transplantation de tissus (valves cardiaques, cornée, peau, tendons, ligaments, vaisseaux, os) s’applique :
Aux autogreffes de tissus
Le donneur et le receveur sont la même personne (greffes de peau, d’os, de tendons et ligaments)
Au sang
C’est le plus couramment greffé : globules rouges, plaquettes sanguines, globules blancs.
À la moelle épinière
À partir de la moelle osseuse, on peut réaliser des autogreffes, des allogreffes familiales (les donneurs sont de la même famille) ou à partir de donneurs non apparentés.
Les organes greffés sont généralement :
• les reins (un seul ou les deux) ;
• le foie (un lobe ou la totalité) ;
• le cœur et les poumons (souvent ensemble) ;
• des sections de l’intestin grêle ;
• le pancréas (en partie ou en totalité).
Sont à l’étude ou en cours d’expérimentation : les transplantations de cellules pancréatiques, musculaires, nerveuses et de fœtus humain.
L'IRM |
L’imagerie par résonance magnétique – l’IRM – étudie avec une grande précision, et produit des images de nombreux organes et tissus de l’organisme, sans émettre de radiations. Récent progrès technique de l’imagerie médicale, elle permet de mettre en évidence des lésions non visibles par des examens classiques tels que la radiographie, l’échographie, le scanner.
Principe
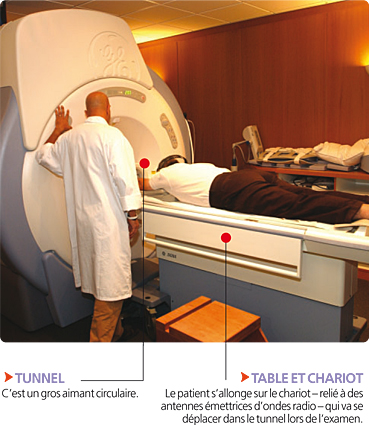
L’IRM utilise un champ magnétique puissant et des ondes qui font vibrer les atomes d’hydrogène – c’est le phénomène de résonance – contenus dans les cellules des tissus biologiques étudiés. Lorsqu’un patient est placé dans le champ magnétique, des antennes connectées à la table d’examen émettent des ondes radio qui stimulent, pendant un temps très court, les noyaux d’hydrogène. Après arrêt de la stimulation, les atomes d’hydrogène restituent l’énergie produite sous forme de signal, analysé et transformé en image, grâce à un calcul informatique.
Intérêts majeurs
Une vision précise de l’organisme
L’IRM permet l’obtention d’une image de grande qualité, dans des plans multiples, en deux ou trois dimensions.
• Presque toutes les parties du corps sont distinguables : organes du thorax (cœur, poumons, bronches, plèvre, etc.) ; digestifs (foie, rate, pancréas, voies biliaires, intestin, côlon, rectum, etc.) ; organes génito-urinaires (reins, ovaires, utérus, prostate, sein, etc.) ; colonne vertébrale et moelle épinière.
• L’IRM fournit des renseignements sur l’anatomie : taille et le volume des organes, mise en évidence de tumeurs, leur taille et éventuellement leur nature (cancéreuse ou bénigne).
• Elle permet de détecter des malformations, des inflammations, des hématomes en formation.
• Elle est particulièrement utile pour l’étude des tissus mous, tendons, ligaments, muscles – mal visualisés par l’imagerie habituelle. Il est possible de déterminer la cause d’une douleur au niveau d’une articulation. C’est un des meilleurs examens pour le diagnostic des traumatismes liés à la pratique d’un sport.
Principales informations obtenues
• hémorragies, ramollissement, tumeurs (cerveau) ;
• sclérose en plaque (moelle épinière) ;
• hernie discale, pathologie infectieuse (colonne vertébrale) ;
• problèmes divers au niveau des articulations (épaules, coudes, poignets, hanches, genoux, chevilles).
• troubles artériels (artères cérébrales, cervicales, etc.). L’IRM donne de précieuses informations en cas de problèmes cardiaques et vasculaires.
Il est également possible d’améliorer le dépistage de pathologies telles les tumeurs en injectant par voie intraveineuse un produit de contraste : le Gadolinium.
L’autre grand intérêt est l’innocuité de cette technique qui utilise un principe physique n’ayant rien à voir avec la radioactivité ; en radiologie classique, les rayonnements X et gamma radioactif sont employés. Aucun risque d’irradiation n’est à donc craindre.

Contre-indications et précautions d’emploi
Dans la mesure où l’IRM utilise un champ magnétique puissant, aucun objet métallique ou ferromagnétique ne doit pénétrer dans la salle d’examen (montres, bijoux, plaques osseuses, implants, corps étrangers métalliques intraoculaires, etc.). Quelques-uns sont compatibles avec la réalisation de l’IRM, il faut s’en assurer.
• Les personnes porteuses de stimulateurs cardiaques, de valves cardiaques métalliques, de pompes à insuline, ne peuvent bénéficier de cette technique (la puissance de l’aimant pourrait entraîner un dysfonctionnement voire l’arrêt de la pile cardiaque).
• La nervosité. Rester immobile – le moindre mouvement peut donner une image de mauvaise qualité – et enfermé dans le tunnel pendant toute la durée de l’examen – trente à cinquante minutes –, en supportant un bruit intense, est éprouvant. Il est proposé des casques musicaux, mais certaines personnes peuvent ne pas supporter l’épreuve.
• De même, la claustrophobie est un facteur limitant car il faut rester allongé dans l’étroit tunnel. Il existe maintenant des appareils non fermés, moins «étouffants».
• Enfin, l’obésité peut interdire l’accès au tunnel, très étroit.
 Les lasers sont devenus des outils privilégiés pour les chirurgiens : en concentrant le faisceau de lumière sur des zones très précises des tissus du corps humain, il est en effet possible de sectionner ou de réparer des tissus, de coaguler des vaisseaux sanguins ou encore de détruire des lésions sans abîmer les zones voisines. Ils s’avèrent beaucoup moins agressifs que les techniques chirurgicales classiques. Non seulement les traitements sont plus rapides, mais ils sont aussi moins traumatiques (geste chirurgical plus précis, incisions plus fines, etc.) et évitent souvent l’hospitalisation. Les lasers ne sont toutefois pas des remèdes miracles car ils comportent des risques comme la brûlure et le vieillissement cellulaire.
Les lasers sont devenus des outils privilégiés pour les chirurgiens : en concentrant le faisceau de lumière sur des zones très précises des tissus du corps humain, il est en effet possible de sectionner ou de réparer des tissus, de coaguler des vaisseaux sanguins ou encore de détruire des lésions sans abîmer les zones voisines. Ils s’avèrent beaucoup moins agressifs que les techniques chirurgicales classiques. Non seulement les traitements sont plus rapides, mais ils sont aussi moins traumatiques (geste chirurgical plus précis, incisions plus fines, etc.) et évitent souvent l’hospitalisation. Les lasers ne sont toutefois pas des remèdes miracles car ils comportent des risques comme la brûlure et le vieillissement cellulaire. Il agit en sectionnant grâce à l’émission d’impulsions très brèves (en dessous du milliardième de seconde) qui produisent peu de chaleur, mais ont une action mécanique semblable à celle d’un bistouri à lame. Son emploi est très large puisqu’il va de la chirurgie très fine de l’œil à certains cancers pulmonaires ou digestifs. Ce laser a en effet l’avantage de pouvoir être introduit à l’intérieur d’une fibre optique, permettant ainsi d’intervenir à l’intérieur du corps.
Il agit en sectionnant grâce à l’émission d’impulsions très brèves (en dessous du milliardième de seconde) qui produisent peu de chaleur, mais ont une action mécanique semblable à celle d’un bistouri à lame. Son emploi est très large puisqu’il va de la chirurgie très fine de l’œil à certains cancers pulmonaires ou digestifs. Ce laser a en effet l’avantage de pouvoir être introduit à l’intérieur d’une fibre optique, permettant ainsi d’intervenir à l’intérieur du corps.







