Le cerveau |
Le cerveau est la partie principale de l’encéphale, qui comprend aussi le cervelet et le tronc cérébral. Protégé par la boîte crânienne, il est composé de deux hémisphères et d’une zone appelée diencéphale. Il ne représente que 2 % du poids du corps, mais les centaines de milliards de cellules qui le composent sont le siège des fonctions intellectuelles et sensitives.
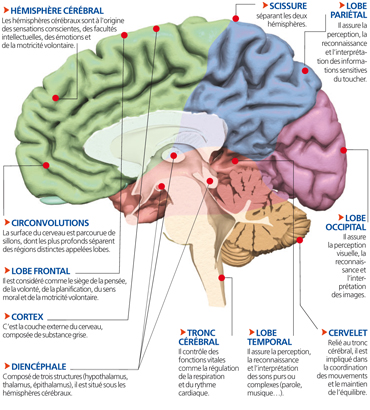
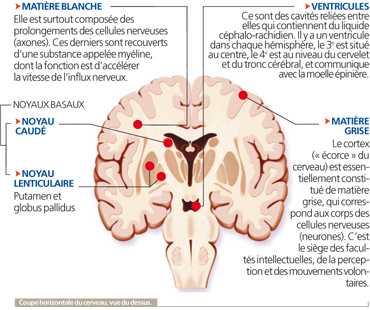
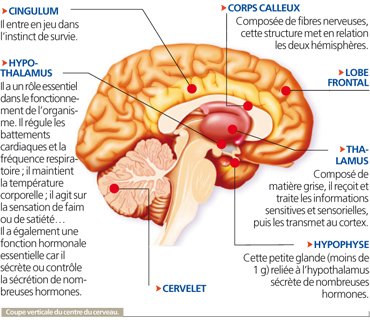
Structure interne
Elle révèle le rôle capital du thalamus, véritable centre de traitement des données transmises ensuite au cortex cérébral.
La cancer de prostate |
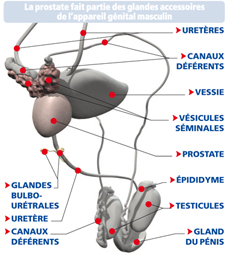 Chaque année, plus de 60 000 hommes sont touchés par le cancer de la prostate, ce qui en fait le plus fréquent de tous les cancers en France. Ce cancer évolue souvent lentement, et de nombreux hommes vivent avec lui pendant des années sans le savoir. Or, plus il est détecté tôt, mieux il est traité. Ce n’est pas un hasard si son dépistage est recommandé après 50 ans.
Chaque année, plus de 60 000 hommes sont touchés par le cancer de la prostate, ce qui en fait le plus fréquent de tous les cancers en France. Ce cancer évolue souvent lentement, et de nombreux hommes vivent avec lui pendant des années sans le savoir. Or, plus il est détecté tôt, mieux il est traité. Ce n’est pas un hasard si son dépistage est recommandé après 50 ans.
Facteurs de risque
Cancer le plus fréquent chez l’homme, le cancer de la prostate représente la deuxième cause de mortalité par cancer chez l’homme en France (plus de 9 000 décès par an). L’âge est le principal facteur de risque (l’âge moyen au niveau du diagnostic est de 74 ans). Il en existe deux autres : les antécédents de cancer de la prostate avant 55 ans chez deux parents proches (frère, père, oncle ou grand-père) et l’origine ethnique, la population noire étant la plus touchée.
Détection
Symptômes
Au début, le cancer de la prostate n’entraîne généralement aucun trouble particulier. À un stade plus avancé, certains troubles peuvent apparaître : difficultés pour uriner, besoins fréquents d’uriner, présence de sang dans le sperme, voire douleurs osseuses, fractures…
Dépistage
Le dépistage du cancer de la prostate repose sur un dosage annuel du PSA (antigène spécifique de la prostate) associé à un toucher rectal chez les hommes de plus de 50 ans ou plus jeunes dans les populations à risque. Uniquement fabriqué par la prostate, le PSA est une substance dont le rôle est de fluidifier le sperme. Son dosage à partir d’une simple prise de sang permet d’évaluer l’état de la prostate. Son taux, qui doit normalement être inférieur à 4, augmente en effet en cas d’infection, d’hypertrophie bénigne ou de cancer.

Diagnostic
• La biopsie. Lorsque le taux de PSA est trop élevé et/ou le toucher rectal anormal, une biopsie (prélèvements de fragments de prostate) est prescrite. Elle permet d’affirmer l’existence du cancer et de le caractériser.
• Le bilan d’extension. En cas de cancer prouvé, un bilan de l’extension du cancer est nécessaire avant de proposer un traitement. Ce bilan inclut un scanner abdominal, une scintigraphie osseuse et, parfois, une imagerie par résonance magnétique (IRM).
Traitement
Le traitement de la maladie dépend essentiellement de son stade au moment du diagnostic.
Pour les cancers localisés
Il existe trois types de traitements. Tous donnent les mêmes résultats et assurent plus de 80 % de guérison dans les formes peu agressives.
• L’ablation de la prostate (ou prostatectomie radicale), qui se pratique soit de façon classique, avec une incision sous le nombril, soit par cœlioscopie (petites incisions permettant l’introduction d’une caméra et des instruments).
• La radiothérapie externe, qui consiste à envoyer des rayons vers la tumeur pour la détruire.
• La curiethérapie, technique récente basée sur l’implantation, dans la prostate, de grains radioactifs destinés eux aussi à détruire les cellules cancéreuses.
Pour les cancers avancés et/ou métastasiques
Le traitement est hormonal, faisant appel à plusieurs types de médicaments qui peuvent être combinés (dont les analogues de la LH-RH et les anti-androgènes). En cas de mauvaise réponse, d’autres traitements sont instaurés (chimiothérapie, traitement radioactif…). Un traitement de la douleur et des complications peut être associé au traitement de fond.
Le suivi du traitement
Il repose sur le dosage répété du PSA qui, sous traitement, devient quasiment indétectable. Une remontée de son taux traduit une récidive ou un échappement thérapeutique.
Laser |
La première application médicale du laser a eu lieu en 1961 ! il s’agissait d’un traitement d’une tumeur de la rétine. Aujourd’hui, le laser est à l’origine de près de 200 000 interventions par an en France et ses applications sont de plus en plus nombreuses.
Définition
Acronyme anglais de Light Amplification by Stimulated Emission of Radiation, le laser se traduit en français par « amplification de la lumière par émission stimulée de radiations ».
Concrètement, il s’agit d’une source de lumière intense émise en règle générale sur une seule longueur d’onde (donc dans une seule couleur) et dans une seule direction, dégageant ainsi localement une très grande densité énergétique.
L’utilisation des rayons laser est très variée en médecine.
Le bistouri du XXIe siècle
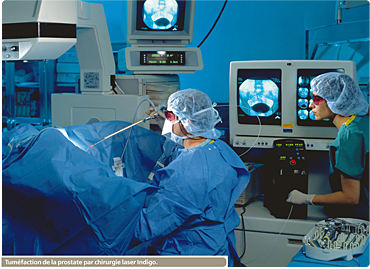
 Les lasers sont devenus des outils privilégiés pour les chirurgiens : en concentrant le faisceau de lumière sur des zones très précises des tissus du corps humain, il est en effet possible de sectionner ou de réparer des tissus, de coaguler des vaisseaux sanguins ou encore de détruire des lésions sans abîmer les zones voisines. Ils s’avèrent beaucoup moins agressifs que les techniques chirurgicales classiques. Non seulement les traitements sont plus rapides, mais ils sont aussi moins traumatiques (geste chirurgical plus précis, incisions plus fines, etc.) et évitent souvent l’hospitalisation. Les lasers ne sont toutefois pas des remèdes miracles car ils comportent des risques comme la brûlure et le vieillissement cellulaire.
Les lasers sont devenus des outils privilégiés pour les chirurgiens : en concentrant le faisceau de lumière sur des zones très précises des tissus du corps humain, il est en effet possible de sectionner ou de réparer des tissus, de coaguler des vaisseaux sanguins ou encore de détruire des lésions sans abîmer les zones voisines. Ils s’avèrent beaucoup moins agressifs que les techniques chirurgicales classiques. Non seulement les traitements sont plus rapides, mais ils sont aussi moins traumatiques (geste chirurgical plus précis, incisions plus fines, etc.) et évitent souvent l’hospitalisation. Les lasers ne sont toutefois pas des remèdes miracles car ils comportent des risques comme la brûlure et le vieillissement cellulaire.
Différents types
Plusieurs types de laser sont utilisés en médecine. Parmi les plus courants, on trouve :
Le laser à gaz carbonique (ou laser CO2)
Selon la puissance et la forme du faisceau, il peut vaporiser une lésion par la chaleur qu’il dégage ou la découper très précisément, comme un bistouri à lame, tout en coagulant. Son avantage est la rapidité d’action et l’absence de saignements. Le chirurgien peut, ensuite, laisser cicatriser ou suturer la plaie opératoire.
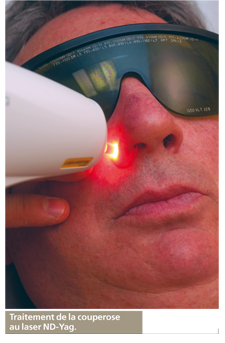
Le laser argon
Il agit par photocoagulation en provoquant de petites brûlures très localisées grâce à l’émission d’une lumière rouge qui va être absorbée par les vaisseaux de la peau. Peu puissant, il ne traite que les lésions superficielles et s’avère surtout intéressant en dermatologie pour le traitement des angiomes plans ou stellaires, de la couperose ou des télangiectasies, ainsi qu’en ophtalmologie pour la prévention du décollement de la rétine, de la dégénérescence maculaire et du glaucome.
Le laser Yag
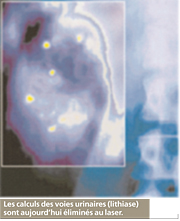 Il agit en sectionnant grâce à l’émission d’impulsions très brèves (en dessous du milliardième de seconde) qui produisent peu de chaleur, mais ont une action mécanique semblable à celle d’un bistouri à lame. Son emploi est très large puisqu’il va de la chirurgie très fine de l’œil à certains cancers pulmonaires ou digestifs. Ce laser a en effet l’avantage de pouvoir être introduit à l’intérieur d’une fibre optique, permettant ainsi d’intervenir à l’intérieur du corps.
Il agit en sectionnant grâce à l’émission d’impulsions très brèves (en dessous du milliardième de seconde) qui produisent peu de chaleur, mais ont une action mécanique semblable à celle d’un bistouri à lame. Son emploi est très large puisqu’il va de la chirurgie très fine de l’œil à certains cancers pulmonaires ou digestifs. Ce laser a en effet l’avantage de pouvoir être introduit à l’intérieur d’une fibre optique, permettant ainsi d’intervenir à l’intérieur du corps.
Le laser Excimer
Il agit par photoablation. L’émission d’une lumière dans l’ultraviolet provoque de petites pertes de substance. Son domaine privilégié est l’ophtalmologie, et plus particulièrement celui du traitement de la myopie ou de certaines opacités superficielles de la cornée.
La vaccination |
 La vaccination consiste à doter l’organisme d’un ensemble de mécanismes de défense durables contre un corps étranger , à l’immuniser contre une maladie définie. Elle a permis l’éradication de la variole , une très forte régression de maladies infantiles graves. Surtout, elle est porteuse d’espoir contre les fléaux de ce siècle que sont le cancer ou le sida.
La vaccination consiste à doter l’organisme d’un ensemble de mécanismes de défense durables contre un corps étranger , à l’immuniser contre une maladie définie. Elle a permis l’éradication de la variole , une très forte régression de maladies infantiles graves. Surtout, elle est porteuse d’espoir contre les fléaux de ce siècle que sont le cancer ou le sida.
Le principe
La vaccination
Le vaccin est un germe microbien auquel on a fait perdre tout ou partie de son pouvoir pathogène, avant de l’injecter dans le corps du patient. Il ne provoque pas la maladie mais, en réaction à leur absorption par les cellules macrophages, les lymphocytes B, globules blancs du système immunitaire, préparent une contre-attaque et se transforment, en grand nombre, en plasmocytes pour secréter une protéine spécifique : l’anticorps. Celle-ci diffusée dans l’organisme va neutraliser le microbe inoculé, appelé antigène . Il reste ensuite, au coeur du système immunitaire, des lymphocytes B mémoire qui, comme leur nom l’indique, gardent en mémoire l’anticorps spécifique à la maladie concernée.
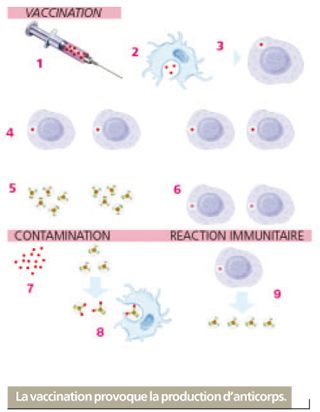 La réaction immunitaire
La réaction immunitaire
En cas de contamination ultérieure par le même antigène, les lymphocytes B mémoire entrent automatiquement en lice, formant un véritable bouclier sanitaire pour protéger l’organisme tandis que le système immunitaire produit massivement de nouveaux anticorps appropriés jusqu’à atteindre le taux suffisant pour vaincre l’infection.
Les différents vaccins
• Les germes tués ou inactivés (coqueluche et grippe) nécessitent des injections répétées et des rappels pour perpétuer l’immunité.
• Les germes vivants atténués (R.O.R, polio, tuberculose). Une seule injection suffit.
• Les anatoxines (diphtérie, tétanos) sont utilisées lorsque la toxine d’un germe est l’agent pathologique principal. Plusieurs injections sont nécessaires.
• Les antigènes (hépatite B) ne contienent que les constituants de l’agent infectieux nécessaire à l’immunité. Ainsi, le vaccin de l’hépatite B, ne contient que des protéines situées à la surface du virus. Cette dernière technique, qui n’utilise qu’un fragment sans danger du microbe, sera de plus en plus utilisée pour les vaccins du futur.
Durée d’action
Elle est en moyenne de :
• 1 an pour la grippe.
• 3 ans pour la typhoïde ou la méningite.
• 10 à 20 ans pour le tétanos, la diphtérie ou la coqueluche.
• 30 à 50 ans pour la rubéole, les oreillons ou l’hépatite B.
Au-delà , les effets du vaccin diminuent. Une nouvelle injection dite « rappel » est nécessaire pour prolonger l’immunité.
En pratique
Les vaccins s’administrent par injection sous-cutanée ou intramusculaire. La vaccination par voie orale (poliomyélite) ou cutanée (ancien BCG) est abandonnée en France, celle par voie nasale (grippe) n’est pas encore au point.
Les vaccins combinés
Si certains vaccins s’injectent seuls (BCG, typhoïde, fièvre jaune, grippe, pneumocoque, méningocoque, hépatite A, hépatite B), d’autres, sont combinés :
• vaccins bivalents : DT (diphtérie-tétanos), hépatites A et B.
• vaccins trivalents : DTP (diphtérie-tétanos-poliomyélite), ROR (rougeole-oreillons-rubéole).
• vaccin tétravalent : DTP + coqueluche.
• vaccin hexavalent : DTCP + hépatite B + Haemophilus HIB.
 Les contre-indications
Les contre-indications
Exceptionnelles, les principales sont :
• un déficit immunitaire congénital ou acquis, à la suite de greffes (vaccins vivants atténués) .
• une allergie antérieure au même vaccin, ou au blanc d’œuf (vaccins contre la grippe, la fièvre jaune, les oreillons, la rougeole) ,
• une grossesse, une infection aiguë, une crise d’allergie (vaccins vivants atténués).
Les effets secondaires
Chaque vaccin présente des risques d’effets secondaires rares et généralement mineurs, comme une petite réaction locale ou un peu de fièvre ; parfois on note une réaction plus spectaculaire comme l’allergie. Les cas les plus graves sont d’exceptionnelles maladies musculaires dues à la présence d’aluminium, indispensable pour stabiliser certains vaccins.
Les bénéfices
La mémoire collective commence à oublier les épidémies de croup («diphtérie»), de variole ou de poliomyélite comme celle qui frappa le Bassin parisien en 1954. Le recul des vaccinations dans certains pays en guerre montre pourtant que la menace est toujours présente.
Les bénéfices individuels
La protection individuelle est variable d’une maladie à l’autre, de 60 % pour la typhoïde à 98 % pour la diphtérie ou le tétanos. Mais si la maladie apparaît quand même, elle est souvent atténuée, dans le cas de la grippe par exemple. Dans celui de la rubéole, le vaccin ne sert pas à protéger contre une maladie, mais contre les conséquences dramatiques de cette maladie sur le bébé quand elle se déclare pendant une grossesse.
Les bénéfices collectifs
Pour les maladies à transmission humaine, la vaccination généralisée fait reculer, voire disparaître, le mal (variole depuis 1977, poliomyélite dans les années à venir). La fréquence de la rougeole, des oreillons, des méningites et otites à Haemophilus, des diphtéries a chuté de manière spectaculaire, même chez les rares personnes non vaccinées.
Se faire vacciner n’est pas seulement un acte individuel, c’est aussi un acte citoyen.
La transmission de l'influx nerveux |
Phénomène de nature électrique qui se propage le long des neurones, l’influx nerveux transmet les commandes motrices du cerveau aux nerfs moteurs, et les messages sensoriels des capteurs sensoriels (peau, oreilles, nez, yeux, récepteurs du goût) au cerveau. Cette transmission de neurones en neurones est assurée par les neurotransmetteurs.
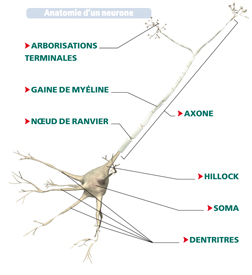 Unité de base
Unité de base
Élément fonctionnel de base du système nerveux, le neurone peut être considéré à la fois comme un relais de transmission et une unité de traitement de l’information.
Constitution
Le neurone est constitué :
• d’un soma, qui contient le noyau
• de dendrites, qui forment une arborisation autour du soma
• d’un axone, qui est un prolongement pouvant  varier d’une dizaine de microns à plus d’un mètre de long chez certains neurones de la moelle épinière. Il se ramifie en quelques milliers de terminaisons, les racines
varier d’une dizaine de microns à plus d’un mètre de long chez certains neurones de la moelle épinière. Il se ramifie en quelques milliers de terminaisons, les racines
• de boutons synaptiques (jusqu’à 10 000 par neurone), qui se trouvent au bout de chaque terminaison axonale et se connectent chacun avec la dendrite d’un autre neurone. Cette connexion s’appelle la synapse.
Transmission
Localisation
Il existe deux sortes de synapses :
• les chimiques, les plus nombreuses, comportent un micro espace, la fente synaptique, entre les deux neurones (ou entre un neurone et une autre cellule). Lorsque l’influx nerveux (ou potentiel d’action) atteint le bouton synaptique du premier neurone, il déclenche la libération de neurotransmetteurs (substances chimiques), qui lui servent de relais en traversant l’espace qui sépare les deux neurones. En s’attachant aux récepteurs synaptiques du second neurone, ils lui transmettent le message qui est à nouveau codé sous forme de signal électrique.

• les électriques permettent le passage direct de l’influx nerveux (sans intermédiaire), grâce à une jonction, sorte de tunnel entre les deux neurones.
Rapidité
Lorsqu’un influx nerveux est émis par le neurone, il transite le long de son axone sans perdre en intensité et peut ainsi avoir un effet à grande distance, d’un hémisphère à l’autre ou des centres moteurs aux muscles. Sa rapidité dépend de la myélinisation de l’axone (un axone comportant une gaine de myéline transmet l’information environ 10 fois plus vite).
Polarisation et dépolarisation
Il existe au niveau des synapses des canaux ioniques, des tunnels qui traversent la membrane et par lesquels des ions entrent et sortent du neurone (principalement des ions sodium, potassium, calcium et chlorure).
Ces canaux sont sélectifs – ils ne laissent passer que certains ion s- et ne restent pas constamment ouverts. Les ions portent des charges électriques positives ou négatives : lorsque le neurone est au repos, les premières sont à sa surface et les secondes à l’intérieur, ce qui crée une différence de potentiel, ou polarité, de part et d’autre de la membrane appelée potentiel de membrane.
Le neurone est alors polarisé, mais son axone reçoit constamment des potentiels locaux captés par les dendrites. Ces messages en provenance d’autres neurones sont soit excitateurs, soit inhibiteurs.














